1. Introducción
La mora de castilla (Rubus glaucus) es uno de los frutales andinos de importancia en el Ecuador. Dentro del país, se han reportado un total de 21 especies de Rubus, entre las más reconocidas están la mora de Castilla, debido a su importancia comercial (Delgado, 2012). Esta fruta se cultiva en todas las provincias de los Andes ecuatorianos, alcanza una superficie cultivada de 5247 ha (SINAGAP, 2016). La extensión cultivada está manejada por alrededor de 15 000 pequeños y medianos productores de la Sierra, los que poseen un nivel tecnológico bajo que requiere mejoramientos a través de programas integrales, manejo fitosanitario y mejoramiento genético (Vásquez, Pupiales, Viteri, Sotomayor, Feican, Campaña y Viera, 2019). La provincia de Tungurahua es la principal productora con un 42 % de superficie plantada, le sigue Chimborazo con el 25 % (MAGAP, 2012).
Una de las enfermedades que ocasiona grandes pérdidas económicas y es considerada como uno de los principales problemas fitosanitarios es la pudrición del fruto, moho gris o pudrición blanda, ocasionado por el hongo Botrytiscinerea (Quinatoa, 2015). Entre las afectaciones más importantes se encuentran la reducción del rendimiento, necrosis del fruto, momificación, quemaduras de las inflorescencias y pudrición del fruto (DANE, 2013).
La afectación por plagas y enfermedades en el cultivo de mora de castilla es la principal limitante. Por esta razón, la implementación del Manejo Integrado de Plagas (MIP) es una prioridad, cuyos componentes son el material de siembra, las labores culturales, plan de nutrición de la planta, uso adecuado de plaguicidas, que permitan el control preventivo de plagas y enfermedades (Jiménez, 2009).
El hongo Botrytis cinerea infecta al cultivo en cualquier estado del desarrollo del fruto y a cualquier parte de la planta, como a los tallos, flores, hojas y frutos (Viteri, et al., 2016). De acuerdo a los estudios que se realizaron en las provincias de Tungurahua, Cotopaxi y Bolívar el porcentaje de daño de esta enfermedad al cultivo puede alcanzar hasta el 91.8 % (Villares, Martínez, Viteri, Viera, Jácome, Ayala y Noboa, 2016).
Durante los últimos años se han desarrollado métodos de control de plagas en los cultivos. Entre los cuales está, el método cultural que consiste en la aplicación de buenas prácticas agrícolas, una adecuada densidad de siembra, podas y fertilización, considerando las necesidades del cultivo (Restrepo, Peñaranda, Jiménez, Galindo, Rivero, Jiménez y Guerrero, 2012). Otro método es el orgánico y consiste en el uso de productos a base de extractos vegetales, que estimulan las neuronas de insectos afectando adversamente al desarrollo de los mismos (Ramón y Rodas, 2007). El biológico que utiliza biocontroladores de plagas y enfermedades. Uno de ellos Eutiliza hongos como Penicillium spp., Trichoderma spp., Gliocadium spp. (Capelo y Roche, 2008). El control que utiliza moléculas de productos sintéticos, es la medida aplicada por la mayoría de los productores, entre los que encontramos el carbendazim (Cardona, García, Barrera, Quejada, Rodríguez y Arroyave, 2014). El genético, a través del uso de variedades resistentes a ciertas plagas y enfermedades y de alta productividad (Jiménez, 2009)
La producción convencional de los cultivos puede ocasionar diferentes efectos negativos como es el aumento de acidez de los suelos, disminución de la fertilidad y reducción de fauna nativa. A nivel del fruto se ha identificado alteraciones en las características fisicoquímicas, olor y sabor (Guevara, 2016). Debido a esto se diseñaron nuevas tecnologías para la implementación de la agricultura limpia y orgánica, basada en el uso de variedades mejoradas, controladores biológicos y fertilizantes de origen natural, esto, con la finalidad de reducir el uso de insumos de origen sintético, proteger la salud de las personas y del ambiente (Martínez, Bello y Castellanos, 2012; Marco Brown y Reyes Gil, 2003).
En los últimos años, la utilización de controladores biológicos ha ido creciendo debido a la efectividad para controlar a fitopatógenos y proteger el ambiente (Van Driesche, Hoddle, y Center, 2007). El uso de Bacilus thuringiensis y Trichoderma harzanium son varios ejemplos en el control de enfermedades (Naher, Yusuf, Ismail y Hossain, 2014). Trichoderma spp. es un hongo saprófito y anaerobio facultativo (realiza la respiración con o sin presencia de oxígeno), perteneciente a la familia Monilia y género Trichoderma. Generalmente se lo encuentra en suelos con gran cantidad de materia orgánica (Martínez, Infante y Reyes, 2013). La eficacia de este hongo en el control de enfermedades se debe a que inhibe el crecimiento de ciertos fitopatógenos a través de la producción de metabolitos (Martínez, Infante y Reyes, 2013).
Con este antecedente, el estudio consitió en determinar el efecto de los productos de síntesis, biológicos y orgánicos en la incidencia de Botrytis sp., calidad físicoquímica y rendimiento del fruto de mora de castilla.
2. Metodología
El estudio se realizó desde el mes de junio hasta noviembre de 2018 en un total de tiempo de 24 semanas, en la granja experimental de la Universidad de las Américas-UDLA, ubicada a 78° 34’ 22” O de longitud, 0° 4’ 24” S de latitud y a una altura de 2720 msnm. La temperatura y humedad relativa promedio fue de 14 °C y 70 %, respectivamente, la precipitación anual de 1161.7 mm, el suelo es franco-arenoso y con un pH de 6.84. La evaluación físicoquímica del fruto se realizó en los laboratorios de la UDLA sede Queri, ubicados a una altura de 2831 msnm, 78° 28’ 14” O de longitud y 0° 10’ 10” S de latitud.
Se utilizó un diseño de bloques completamente al azar (DBCA) con cinco tratamientos y tres repeticiones. Se realizó un análisis de varianza aplicando la prueba de Tukey al 5 %. Los tratamientos fueron T1: testigo (silwet+agua) con una dosis de 0.15 cc l-1, T2: producto sintético (Carbendazim) en dosis de 1 cc l-1, T3: producto orgánico (extracto de mirtáceas) con dosis de 3 cc l-1, T4: microorganismo benéfico (metabolitos bacterianos) con dosis de 8 cc l-1 y T5: microorganismo benéfico (Trichoderma spp.) con dosis de 0.37g 20 l-1. La aplicación del testigo, producto orgánico y microorganismos benéficos fue cada 8 días, mientras que el producto comercial se aplicó cada 15 días.
Los datos meteorológicos desde el mes de junio hasta noviembre se obtuvieron de la estación meteorológica de Nono ubicada dentro de la granja experimental de la UDLA. Se recopilaron los datos diarios de precipitación a las 07, 13 y 19 horas. Se utilizó un data logger (Hobo Pro v2), colocado en las parcelas de mora, para recolectar los valores de temperatura máxima, temperatura mínima y humedad relativa diaria por hora.
Las variables que se estudiaron fueron: incidencia de la enfermedad en el fruto (%), semanalmente se registró la presencia de la enfermedad en los frutos cosechados el porcentaje estuvo en relación con los frutos sanos. El rendimiento (g/parcela) se evaluó por 6 meses, para esto se consideró el rendimiento de las cosechas semanales de cada tratamiento (parcela neta). La cosecha se hizo en el grado de madurez 3, utilizando un colorímetro Lovibond LC100 (figura 1).
Figura 1 :
Color de la fruta a cosechar según especificaciones
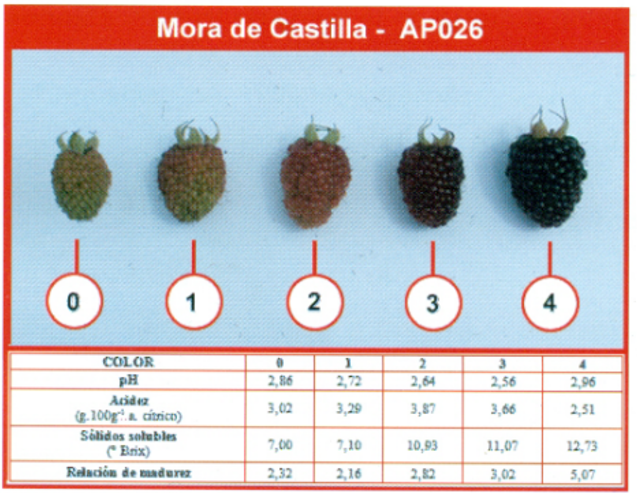
Fuente: (Brito, Montalvo, Freire, Vásquez, Viteri, Martínez y Jácome, 2016)
Las variables de calidad física y química del fruto se registraron cada mes y fueron peso del fruto (g), quese determinó tomando al azar de cada tratamiento 10 frutos y al final se calculó la media aritmética. El pH (log H+) que se obtuvo por la medición de un extracto producto de la maceración de 15 g de fruta, con el uso de un potenciómetro. Los SST (°Brix) se midieron a partir de 1 g de fruta colocado en un refractómetro. La acidez titulable (% ácido cítrico) se realizó con 30 g de jugo de mora mezclado con 200 ml de agua destilada, que luego fue titulado con NaOH 1N hasta llegar a un pH de 8-8.2. El diámetro polar y ecuatorial (mm) se midió con un calibrador para luego calcular la media aritmética. Para la firmeza (N) se tomaron 5 frutos representativos y al azar de cada tratamiento, se midió con un penetrómetro para obtener luego la media aritmética.
3. Resultados y discusión
Al realizar la evaluación semanal (24) de la incidencia de Botrytis spp. en los frutos de mora, se determinó la existencia de diferencias estadísticas entre los tratamientos en las semanas 28, 41 y 45. En la semana 28 (9-julio-2018) con un valor de p (0.0078), se evidenció que el testigo y las plantas tratadas con metabolitos bacterianos no presentaron la enfermedad, mientras que las plantas tratadas con Trichoderma spp. tienen la mayor incidencia con 10.53 %. Esto pudo deberse a que no sucedió la esporulación de Trichodermaspp. por las condiciones ambientales secas, ya que el hongo necesita humedades entre 70 % y80 % para su crecimiento (Vásquez J. , 2010).
Por otro lado, se evidencia que en las semanas 41 (08-octubre-18) con un valor de p (0.0349) y 45 (05-noviembre-18) con valor de p (0.0389), los productos metabolitos bacterianos, mirtáceas, carbendazim y Trichoderma spp. tuvieron un control similar sobre la enfermedad; siendo iguales estadísticamente entre ellos, pero diferentes al testigo. El comienzo de las precipitaciones en el mes de octubre (total 4.60 mm) y las temperaturas (promedio de 12.81 °C) pudieron haber favorecido en la incidencia de Botrytis sp.
Tabla 1
Incidencia de Botrytis sp en los frutos de mora de castilla después de la aplicación de productos de diferentes orígenes en los Andes del Ecuador
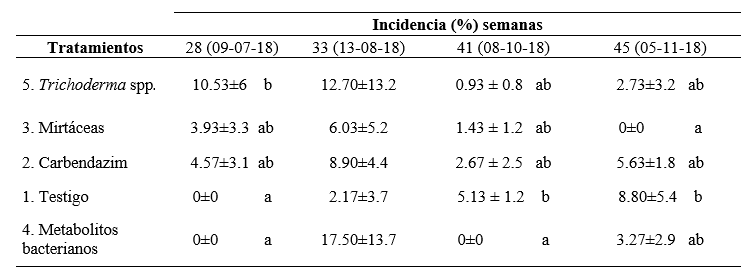
En general, el uso del producto de origen orgánico prácticamente fue muy similares al de origen sintético en el control de la enfermedad, sin embargo, fueron mejores en comparación con el controlador biológico como Trichoderma spp. Este resultado concuerda con lo reportado por Alencastro (2011), quien indica que los productos con mayor efectividad en el control del hongo Botrytis cinerea o moho gris son los benzimidazoles (Carbendazim) y dicarboximidas, esto se debe que tienen un mayor espectro de acción. De igual manera Tello, Oña, Jarrín y Viera (2018) afirman que existe una inhibición del 100 % en el crecimiento micelar con la aplicación de carbendazim.
Hincapié, Saldarríaga y Díaz (2016) indican que un monitoreo de las condiciones climáticas, severedidad de las enfermedades y la aplicación de productos sintéticos en rotación con productos biólogicos es uno de los mejores tratamientos en el control de Botrytis cinerea.
Además (Martínez, Villacís, Viera, Jacome, Espín, León y Rita, 2019) pascual determinan la necesidad de incluir Trichodermaspp. en el manejo limpio ya que las cepas colonizan las raíces protegiéndolas de cualquier patógeno. De esta forma las ramas en producción se verán sanas al igual que los frutos.
Para la variable peso del fruto, el efecto de los tratamientos no influyó por lo que no hubo diferencias estadísticas al 5 %, sin embargo, existieron fluctuaciones del peso ya que hubo variaciones entre 2.73 y 6.72 g (tabla 2).
Tabla 2
Peso del fruto de mora de castilla después de la aplicación de productos de diferentes orígenes en los Andes del Ecuador
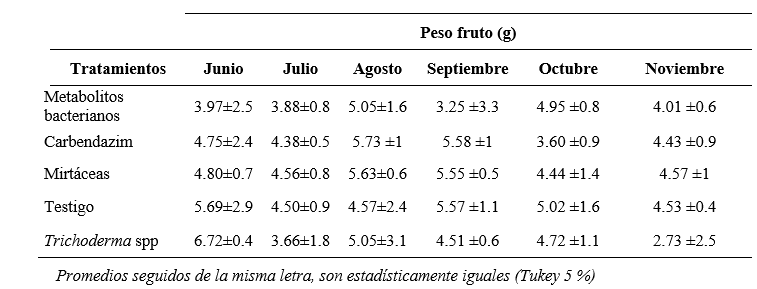
De acuerdo con (Merchán, 2014) la fluctuación de peso se debió a la eficiencia de la cepa de Trichoderma, ya que este hongo influye directamente en la asimilación de nutrientes en la planta que a su vez pudo generar frutos de mayor o menor tamaño. Por otro lado, Sánchez, Villares, Niño y Ruilova (2018) indican que estas diferencias o fluctuaciones en el tamaño de los frutos pueden estar influenciadas por las temperaturas bajas. Otra de las posibilidades para las variaciones en peso del fruto puede ser el manejo agronómico del cultivo, especialmente el riego, ya que aporta con un mayor número de frutos y de mayor calibre (Rodríguez, 2018).
En las variables firmeza del fruto y solidos solubles totales (tabla 3) existieron diferencias estadísticas al 5 % en el mes de septiembre (semana 39), siendo el testigo el que presentó frutos con mayor firmeza (1.59 N). Mientras que la mayor cantidad de SST alcanzó los tratamientos en los que se aplicó Trichoderma, el testigo y metabolitos bacterianos. Por otro lado, en las evaluaciones realizadas entre los meses de junio a noviembre, no existió efecto de los tratamientos en las variables antes indicadas. Las condiciones ambientales predominantes durante el período de evaluación fueron muy cambiantes en la zona de estudio, favoreciendo en unos casos el crecimiento del patógeno y/o inhibiendo el desarrollo del microorganismo benéfico para controlar la enfermedad. Esto se evidenció, puesto que las lluvias se presentaron en septiembre (1.21 mm) y temperaturas de 24.68 °C en promedio, condiciones ambientales diferentes a las de los meses secos (junio a agosto) que tuvieron una precipitación promedio de 0.15 mm.
Tabla 3
Firmeza del fruto N y sólidos solubles totales °Brix de mora de castilla después de la aplicación de productos de diferentes orígenes en los Andes del Ecuador
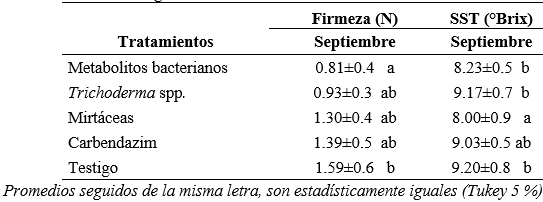
La disminución de la firmeza en los frutos con la aplicación de metabolitos bacterianos pudo implicar que, debido a la precipitación anteriormente mencionada en el mes de septiembre, generó una susceptibilidad en el ablandamiento del fruto causado por Botrytis. Esto pudo activar el proceso de degradación de la pared celular, dando como resultado esta disminución en la firmeza (Merchán, 2014).
Otra de las razones de este hecho es que a medida que aumenta el estado de madurez de los frutos, las paredes celulares se vuelven más débiles y empiezan a perder agua debido al comportamiento de la enzima hidrolasa. Es por esto que se debe realizar la cosecha con un grado de madurez óptimo del fruto, ya que la pared celular de un fruto con madurez alta tiende a degradarse más rápido que un fruto con madurez temprana (Deaquiz y Brigitte, 2015).
En cuanto a la variable de SST, existieron diferencias significativas al 5 % únicamente en el mes de septiembre (tabla 3), durante este mes alcanzaron un promedio de 8.72 °Brix. Durante la semana 39 y la semana 37, correspondiente al mes de septiembre, se registró una de las temperaturas más altas (26.77 °C) y una nubosidad de cinco octavos (fracción del cielo cubierta de nubes) correspondientemente. Las altas temperatura y la nubosidad que se presentaron posiblemente afectó a la formación de azúcares solubles en los frutos. De acuerdo a Deaquiz y Brigitte (2015), se mencionó que la variedad Rubus glaucus tiene una gran cantidad de SST en comparación con el resto de las variedades existentes. Esta variedad puede registrar hasta 11.3°Brix de acuerdo al piso altitudinal que se encuentre y a las diferentes características climáticas. En otro estudio, se obtuvieron valores promedios de °Brix menores a los reportados anteriormente, lo que confirma que la alta luminosidad o insolaciones están directamente relacionadas con la formación de SST en las primeras etapas de fructificación (Grijalba, Calderón y Pérez, 2010).
En cuanto a la variable de acidez (ácido cítrico), los productos que se aplicaron no influenciaron en la acidez del fruto de mora de castilla, puesto que no existieron diferencias estadísticas entre los tratamientos. Como se observa en la tabla 4. En general, la mayor acidez fue de 2.16 y la menor fue de 1.28.
Los valores de acidez obtenidos en este estudio están acordes con lo reportado por Iza, Rojas y Arguello (2016), quienes indican que la acidez titulable de la mora esta entre 2.20 a 2.47 %. De igual manera, identificaron que la disminución de la acidez se debe al grado de madurez de los frutos, ya que, a mayor grado de madurez, la tasa de respiración y el contenido de azúcares solubles aumentan.
Tabla 4
Acidez y pH del fruto de mora de castilla después de la aplicación de productos de diferentes orígenes en los Andes del Ecuador
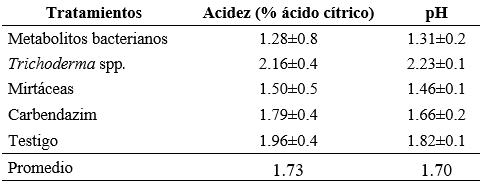
Para la variable del pH del fruto no se presentaron diferencias significativas al 5 %, sin embargo, el mayor valor (2.23) se obtuvo al realizar el control de Botrytis sp. con el uso de Trichoderma spp. y el valor mínimo con los metabolitos Bacterianos (1.31). Ayala, Valenzuela y Bohórquez (2013) registraron ligeros cambios en el pH pero con un rango promedio de valores entre 2.64 y 2.88; estas variaciones en el pH están relacionadas con el grado de madurez del fruto. El incremento o disminución del pH en los frutos está directamente relacionado con las condiciones climáticas, ya que a mayor temperatura en los primeros días del manejo poscosecha puede existir variación en la composición química del fruto (Iza, Rojas y Arguello, 2016).
4. Conclusiones y recomendaciones
Al inicio del experimento los efectos para controlar Botrytis sp. no fueron tan significativos como al finalizar el estudio ya que durante los meses del período seco (junio-agosto) no existieron las condiciones ambientales óptimas para el desarrollo del hongo. Sin embargo, en los meses en que inicio las lluvias (septiembre y noviembre), los productos con mejores resultados para controlar la enfermedad fueron Trichoderma spp., extracto de mirtáceas y Carbendazim.
Los diferentes tratamientos aplicados en el estudio no afectaron a la calidad física y química de los frutos de mora de castilla.
Es recomendable, repetir el estudio en el período lluvioso (óptimo para el desarrollo del patógeno) para confirmar los resultados de esta investigación.
5. Agradecimientos
Los autores agradecen a AgReserach por la asistencia técnica y al Gobierno de Nueva Zelandia (MFAT New Zealand) por el financiamiento brindado. Este artículo forma parte del II Simposio Internacional de Producción Integrada de Frutas 2019.





