Journal Information
Title: Enfoque UTE
Abbreviated Title: Enfoque UTE
ISSN (print): 1390-9363
ISSN (electronic): 1390-6542
Publisher: Universidad UTE (Quito, Ecuador)

El bosque siempreverde de tierras bajas clasificado por Harling (1986) como bosque lluvioso de las tierras bajas, cubre el norte de las tierras bajas de la costa del Pacífico bajo los 700 m de elevación, la mayor parte de Esmeraldas, las áreas adyacentes de la provincia de Pichincha y áreas pequeñas del norte de Manabí y Los Ríos. Este tipo de vegetación también cubre virtualmente todas las tierras bajas de la Amazonía al este de los Andes. También se caracteriza por un clima con una precipitación anual por sobre los 3000 mm., y carece de una estación seca marcada (es decir, generalmente no más de un mes con menos de 100 mm de precipitación). Este es el tipo de vegetación más extenso en el país, que cubre más de un tercio del Ecuador continental (Neill 1999).
El bosque siempreverde de tierras bajas es alto, denso y siempre verde, con el dosel frecuentemente de 30 m., o más de altitud y una diversidad alta de especies. La diversidad alfa de los árboles, como se muestra en las parcelas permanentes de una hectárea, es más alta en la Amazonía ecuatoriana que en el área del bosque lluvioso en el norte de la costa del Pacífico (Neill, 1999). El bosque siempreverde de tierras bajas del noroeste del Ecuador es muy similar al de la región del Chocó colombiano de la costa del Pacífico y comparte muchas especies, pero hay también un elemento significativo de especies endémicas que no se conocen al norte de la frontera colombiana (Neill, 1999); muchas especies están también distribuidas en los bosques húmedos de la Amazonía y/o en América Central (Valencia et al., 1998).
Por lo manifestado anteriormente, el objetivo de este trabajo es contribuir al conocimiento de la composición y diversidad de especies leñosas mayor de 10 cm de diámetro a 1.30 m sobre el suelo (DAP), encontrada en 9 transectos (unidades muestreales) del “bosque lluvioso de tierras bajas, en dos localidades de la Costa y una en la Amazonía basados en el “IV” (índice de valor), diversidad y similitud.
El presente estudio se realizó en 3 localidades (tabla 1) de la Costa y de la Amazonía ecuatoriana que pertenece a la formación de “bosque siempreverde de tierras bajas” (Sierra, 1999).
Durante el 2012 y 2013, se procedió a inventariar 9 transectos de 1000 m2, en forma de zig-zag cada uno con cinco líneas de 50x4 m cada una con rumbo al Norte (Caranqui, 2011); (Cerón ,2003); (Phillips, 2002), ubicados dentro de las zonas de estudio, éstas zonas se escogieron por las facilidades brindadas por sus propietarios. Se midieron todos los árboles iguales o mayores a 10 cm de DAP. Se colectaron especímenes de los individuos fértiles. Las muestras se prensaron y fueron secadas e identificadas por el autor en el Herbario de la Escuela Superior Politécnica de Chimborazo (CHEP), y verificado la información en Jorgensen (1999) y en la base de datos (Missouri Botanical Garden).
Se realizaron los siguientes cálculos (Cerón, 2003):
Área Basal (AB)
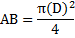
Donde
AB = Área basal
D = DAP Diámetro a la altura del pecho (1.30m.)
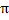 = 3.1416(constante)
= 3.1416(constante)
Densidad = Número de árboles en la parcela
Densidad Relativa (DR)
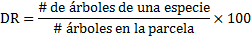
Dominancia Relativa (DMR)
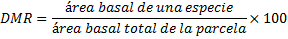
Índice de Valor (IV)
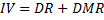
Además en cada uno de los transectos con sus respectivas frecuencias se obtuvieron: riqueza, diversidad (índice de Simpson), e índice de similitud (Bray Curtis, 1957), calculados en el programa PAST.
Según (Golicher, 2012), la fórmula para el índice de Simpson es:
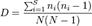
Donde S es el número de especies, N es el total de organismos presentes (o unidades cuadradas) y n es el número de ejemplares por especie.
Enla ecologíayla biología, la disimilitud Bray-Curtis (1957), es una estadística que se usa para cuantificar la disimilitud en la composición entre dos sitios diferentes, basadas en conteos en cada sitio. Según la definición de Bray y Curtis, el índice de similitud:
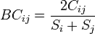
Donde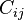 es la suma del valor menor para únicamente aquellas especies en común entre ambos sitios.
es la suma del valor menor para únicamente aquellas especies en común entre ambos sitios.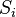 , y
, y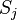 son el número total de especímenes contados en ambos sitios.El índice se reduce a 2C / 2 = C, donde la abundancia en cada sitio se expresan como un porcentaje. El tratamiento adicional se puede encontrar en Legendre y Legendre. La disimilitud de Bray-Curtis está directamente relacionada con elíndice de similitud de Sørensen
son el número total de especímenes contados en ambos sitios.El índice se reduce a 2C / 2 = C, donde la abundancia en cada sitio se expresan como un porcentaje. El tratamiento adicional se puede encontrar en Legendre y Legendre. La disimilitud de Bray-Curtis está directamente relacionada con elíndice de similitud de Sørensen
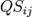 entre los mismos sitios:
entre los mismos sitios:
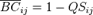 .
.
La disimilitud de Bray-Curtis está obligado entre 0 y 1, donde 1 significa que los dos sitios tienen la misma composición (es decir que comparten todas las especies), y 0 significa que los dos sitios no comparten ninguna especie. En los sitios con donde AC es intermedia (por ejemplo, AC = 0,5) este índice se diferencia de otros índices comúnmente utilizados.
En total se obtuvo 156 especies,107 Géneros y 39 familias, las familias con más especies son: Moraceae con 18, Fabaceae con 16 especies, Urticaceae con 12, Meliaceae con 10, Rubiaceae con 8, Euphorbiaceae con 7, Arecaceae , Myristicaceae, Sapotaceae y Melastomataceae con 6; el resto de familias con valores menores. Estas diez familias mencionadas (de las 39 familias en total), contienen 95 especies es decir el 60.89% del total de familias.
En la Tabla 2 se encuentra las treinta especies con mayores índices de valor (IV), distribuidas en los 9 transectos, en la mayoría de los casos no se repiten las especies en los transectos, las especies que lo hacen con mayor frecuencia son: Ficus tonduzii Standl., Guarea kunthiana A.Juss, en 5 de los 9, Trichilia pleeana (A.Juss.) C.DC., en dos de los 9 transectos pero con valores mayor de 25% “IV”, El resto de especies no tienen representabidad en menos del 20% de los transectos en estudio.
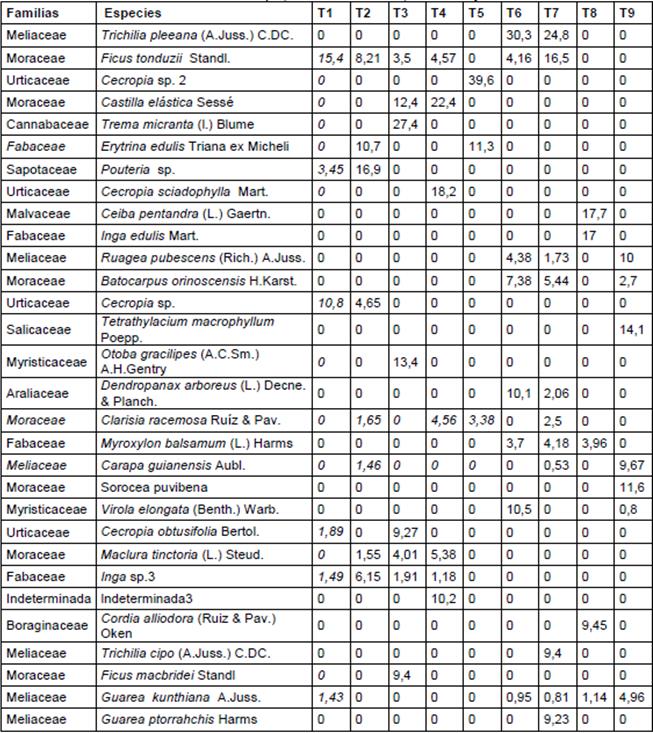
Con respecto al mayor valor de “IV”, pertenece a la especie Cecropia sp.2 con 39,56% que solo está en el T5, Trichilia pleeana (A.Juss.) C.DC. con 30.32% en el T6 y 24.84 en el T7, Ficus tonduzii Standl con el 16,47 en el T7. Como se puede apreciar entre los 10 “IV” altos solo Cecropia sp.2 tiene valor alto en un solo transecto; si a los 10 “IV” mayores agrupamos en las familias respectivas, tendremos que las familias más representativas son Urticaceae, Moraceae y Fabaceae con 2 especies y el resto se distribuyen en familias como Cannabaceae, Sapotaceae, Malvaceae y Meliaceae.
El listado de especies (Tabla 2) se ingresó en el programa PAST generándose el índice de diversidad de Simpson que fluctúa de 0.92- 0.95 (Tabla 3), el cual resulta que los valores son altos en base al número de especies e individuos en cada transecto ya que todos los valores son cercanos a 1. En cuanto a la relación entre el número de especies y de individuos no encontramos un patrón común, ya que los transectos con alto número de especies e individuos no alcanzan los altos valores del índice de diversidad.
La Figura 1 indica que hay 4 grandes grupos:1) integrado por los transectos 1-4, 2) conformado por el T5, 3), conformado por T8; tanto el T5 y el T8 fueron tomados de sitios disturbados y 4), conformado por T6-T7 y T9.
Hay varios subgrupos que tienen dicotomía o cierta dicotomía, generalmente se agrupan por localidad es decir 1-4: Río Palenque, 6-7: Shushufindi, y el T9 no tiene dicotomía por ser un transecto en localidad única; como mencionamos el T5 y T8 son muy diferentes del resto por ser de sitios disturbados.
Según Jorgensen & León Yánez (1999), la comparación de la composición de especies en las cuatro diferentes regiones revela bajos niveles de similitud entre ellas pero la similitud más alta se encuentra entre la Amazonía y la Costa. Por tal razón en términos generales, a nivel de familias coiciden con los grandes grupos encontrados como Fabaceae, Moraceae, Melastomataceae, Meliaceae, Rubiaceae, Urticaceae (Cecropia), Euphorbiaceae y Arecaceae coincidiendo con otros estudios: Cerón (1997), Balslev (1987), Romero et-al (2001), Phillips (2003), Bonifaz & Cornejo (2004).
Los valores del “IV” no superan el 40%, esto puede suponer que las especies se encuentran distribuidas por todo el bosque pero, como ocurre en toda comunidad diversa, su abundancia es poco equitativa (Hubbell & Foster, 1992).
El índice de Simpson indica la relación entre riqueza o número de especies y la abundancia o número de individuos por especies en cualquier sitio dado (Moreno, 2001; Smith & Smith, 2003); excepto para el caso de unas pocas especies de una comunidad no hay ninguna relación entre la riqueza de una comunidad (número de individuos) y su diversidad En los transectos en estudio obtuvimos índices que van de 0.92 a 0.95 que es una diversidad alta como en Conditt (2002), Romero (2001), Pitman (2001) y Valencia (2004). La “hipótesis de la perturbacion intermedia” en Rabinowrtz (1986), propone que en términos de la composición de especies una comunidad nunca alcanza el equilibrio y que una alta diversidad es el resultado de un constante cambio en las condiciones del ecosistema. El modelo de la perturbación intermedia postula que la diversidad de especies alcanza su máximo cuando las perturbaciones ocurren a frecuencias e intensidades “intermedias”; es decir a perturbaciones intermedias mayor diversidad, es por ello que en las zonas de estudio se pudo observar bosque secundarios con distinto grado de conservación que se han agrupado en menor o mayor grado excepto el T5 y T8 que son bosques disturbados lo corrobora el dendrograma de Bray Curtis (Fig.1).
A comparación de otros ecosistemas en el Ecuador, los bosques húmedos tropicales amazónicos tienen muchos estudios, pero la mayoría de ellos es en base a parcelas permanentes de 1 Ha (Ter teege et-al 2013; Conditt et-al 2002; Valencia et-al 2004). Cuando se popularizaron los estudios de diversidad de bosques en el Ecuador la metodología empleada fue diseñada por Alwin Gentry (Phillips 2003), que despertó el interés para hacer estudios de mayor tamaño; no por esto deberían ser desestimados actualmente los estudios de transectos (Caranqui, 2011), ya que 1000m² es un área mínima para encontrar información importante sobre ecología de los bosques amazónicos (Romero, 2001; Phillips, 2003), es ideal hacer parcelas de 1Ha, pero ello conlleva a mayor recursos. En este estudio se ha confirmado que los datos cuantitativos (familias), y conceptos ecológicos coiciden con los datos en las que se ha realizado en una hectárea.
La biodiversidad de los transectos según el índice de diversidad de Simpson es alto entre los transectos estudiados (0.87-0.95). Pero al comparar los transectos con las especies y sus valores los transecto 5 y 8 son diferentes al resto de transectos; esto se debe a la perturbación intermedia que sufren estos bosques.
Con los resultados presentados la familia Fabaceae tienen los mayores valores y coinciden con los estudios existentes de este tipo de bosque.
Doy fe de agradecimiento a las siguiente personas que colaboraron con la realización de este documento: Blgo. Fredy Villao, Dr. Bryan Maclaren, Blgo Xavier Cornejo , Dr. Tim McDowel, Ing. Marcelo Pino, Msc. Alina Freire, estudiantes de Maestría Forestal UTEQ 2012.
Golicher, D. (2012). ¿Cómo cuantificar la diversidad de especies? http://www.dfpd.edu.uy/cerp/cerp_norte/cn/Biologia/BIODIV/Como%20cuantificar%20la%20diversidad,%20algunos%20ejercicios.pdf.
Missouri Botanical Garden. (2013). Base de datos trópicos. htpp://www.tropicos.org.