Journal Information
Title: Enfoque UTE
Abbreviated Title: Enfoque UTE
ISSN (electronic): 1390-6542
Publisher: Universidad UTE (Quito, Ecuador)

La muña (Minthostachys mollis) es una hierba andina silvestre que crece entre 2 500 y 3 500 msnm y está dispersa a lo largo de la cordillera de los Andes. En el sur del Perú, dicha hierba crece en los departamentos andinos de Junín, Ayacucho y Cuzco, específicamente en setiembre (primavera), cuando brotan las primeras hojas (Cano et al., 2008). En 2017, en el Perú los adultos mayores consumieron el 5.8 % de esta hierba (Aguirre Tipismana 2017; Instituto Nacional de Estadística e Informática–Perú, 2017), sea para aliviar dolores digestivos o respiratorios (Roersch, 2016), o lo aplicaron, por ejemplo, como repelente de insectos durante el almacenamiento de papa, debido a su alto contenido de terpenoides en el aceite esencial. A pesar de estas cualidades, su consumo es reducido por la escasa diversificación y el desconocimiento de sus propiedades medicinales.
La planta y las hojas de la muña tienen un papel importante, ya que también son usadas como analgésico, antiespasmódico y antiséptico contra el reumatismo y las enfermedades respiratorias. Estas propiedades medicinales podrían ser atribuidas a su alta capacidad antioxidante y contenido de calcio y fósforo, los cuales contribuyen a mantener los huesos, y en algunos casos, también se han utilizado para el desarrollo de productos nutracéuticos (Cano et al., 2008; PromPerú, 2021). Pucurimay et al. (2018) estudiaron el uso medicinal de las hojas de muña para analizar el efecto de los alcaloides y fenoles. Las hojas de las plantas medicinales poseen un alto contenido de agua, la principal responsable del aumento de las actividades metabólicas y los cambios químicos y físicos que experimenta el producto durante el almacenamiento. Por lo tanto, es fundamental reducir el contenido de agua mediante un proceso que permita mantener la calidad y funcionalidad de las hojas medicinales después de la cosecha.
Existen diversos métodos para conservar los atributos nutricionales y de calidad de los alimentos. Uno de estos es el secado, el cual permite preservar la calidad y estabilidad de los alimentos al reducir la actividad del agua a través de la disminución del contenido de humedad, para evitar su deterioro durante el almacenamiento; por consiguiente, se obtiene productos con alto contenido de vitaminas, minerales y fibra, considerados alimentos funcionales (Lemus-Mondaca et al., 2015). Asimismo, este proceso reduce el peso y el volumen de las hojas, lo cual disminuye los costos de transporte y almacenamiento.
La temperatura del aire de secado depende de la sensibilidad de los ingredientes activos de la hoja al calor, así como la tasa de migración de humedad; es decir, cuanto mayor sea la temperatura utilizada, más rápido será el proceso de secado. La temperatura debe elegirse con mucho cuidado, porque si es demasiado alta podría causar quemaduras en la superficie de las hojas (Dorneles et al., 2019). El método más empleado para el secado de hojas es el secado directo o indirecto mediante energía solar, sin embargo, este método a menudo presenta desventajas relacionadas con la falta de control en el proceso, calidad del producto final, aspectos microbiológicos e inocuidad alimentaria. Otros posibles métodos por aplicar son el secado por aire caliente (Przeor et al., 2019), secado convencional con microondas (Khodja et al., 2020) y la osmodehidrocongelación (Bosco et al., 2018) que permiten mantener la calidad del producto final.
El modelado matemático y la simulación de la curva de secado permiten obtener un mejor control del proceso y conseguir un producto de alta calidad. Asimismo, son empleados para evaluar la cinética de secado, estudio de variables y optimización de parámetros de secado, debido a que minimiza el daño al producto final, disminuye el consumo excesivo de energía y el desgaste excesivo del equipo de secado, además, incrementa el rendimiento (Lemus-Mondaca et al., 2015; Fernando & Amarasinghe, 2016). Algunas de las ecuaciones empíricas generalmente utilizadas para estudiar y modelar la cinética de secado de alimentos son Midilli, Newton, Page, Peleg, Henderson-Pabis, Page modificado, logarítmica, Wang and Singh y exponencial (Babu et al., 2018). El objetivo de llevar a cabo esta investigación fue evaluar la influencia de la temperatura de secado sobre la cinética y coeficiente de difusión, así como determinar las propiedades termodinámicas de las condiciones de secado mediante la energía de activación, entalpía, entropía y energía libre de Gibbs en hojas de muña.
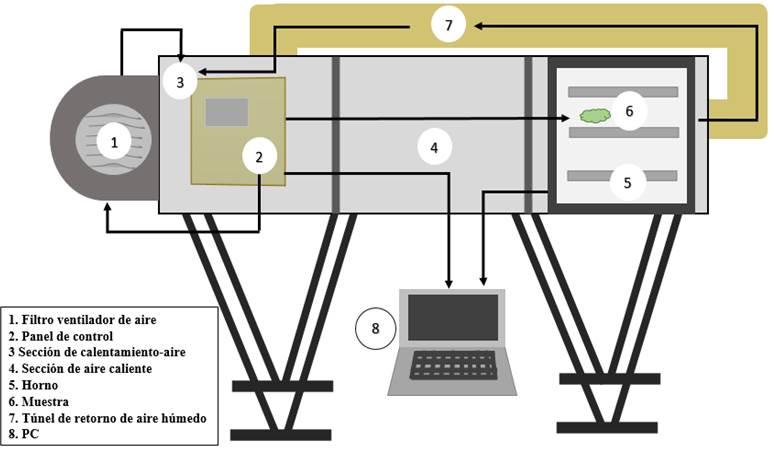
2.1. Materia prima
Se recolectaron plantas de muña de 30 ± 2 cm de altura en enero de 2019 en la ciudad de Huancayo, departamento de Junín, a 3 300 msnm (12° 04′ 00′′ S, 75° 13′ 00′′ O). Se seleccionaron hojas de 2 ± 0.5 x 1 ± 0.2 cm, verdosas, sin manchas marrones o quebradas. Estas fueron colocadas sobre papel kraft y almacenadas en bolsas de polipropileno a temperatura ambiente. La humedad se determinó en una balanza digital de humedad Pesacon, MX-50, Perú.
2.2. Acondicionamiento de la materia prima
Para el acondicionamiento de las hojas antes del proceso de secado, se eligieron tres pretratamientos: hojas sin pretratamiento (SB), hojas tratadas por inmersión en solución de ácido ascórbico al 1 % por 30 s a 40 °C (BAA) y hojas sometidas a un proceso de blanqueado a 60 °C por 30 s (B60). Para los dos últimos tratamientos, se trabajó con una relación hojas: agua de 1:10; en este proceso las muestras fueron limpiadas con papel adsorbente para retirar el exceso de agua para someterlas al proceso de secado (Da Rocha et al., 2012).
2.3. Proceso de secado
Este proceso se hizo en un secador de túnel con bandejas Espacio tiempo, HSB01, Perú, para controlar la velocidad y la temperatura de entrada de aire, el cual se calienta a través de resistencias eléctricas (Figura 1). Se utilizaron tres temperaturas en el estudio de la cinética de secado: 40, 50 y 60 °C, cada tratamiento se ejecutó por triplicado. El flujo de aire de secado se mantuvo constante a 2.0 ± 0.2 m/s y la humedad relativa de entrada fue de 68.08 ± 0.60 %. Se colocaron 460 ± 0.5 g de hojas como peso inicial para cada tratamiento sobre bandejas de acero inoxidable. La variación de peso se midió en una balanza analítica Ohaus SP402, USA, con una precisión de ± 0.001 g en intervalos de tiempo de 30 min. El tiempo de secado se determinó al registrar un peso constante (Przeor et al., 2019).
2.4. Modelos matemáticos
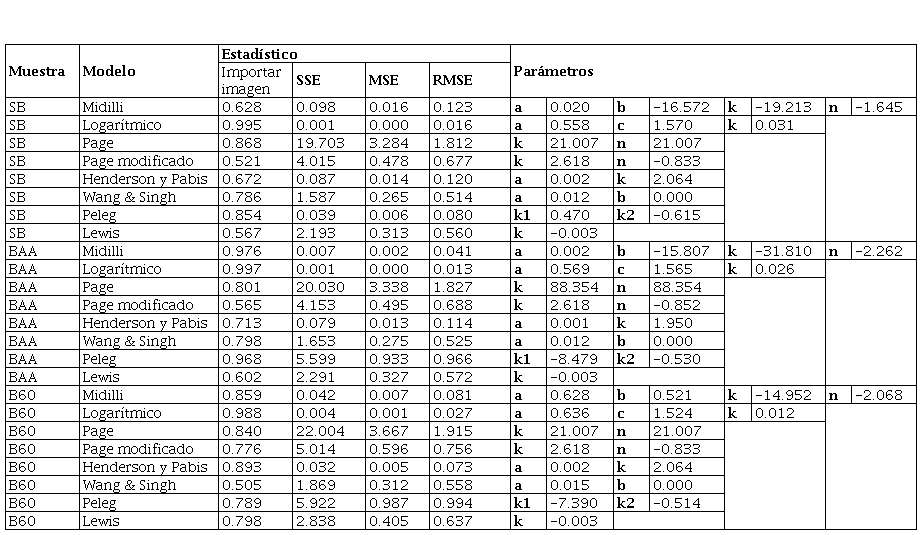
El proceso de secado, en términos de calidad del producto y costos de operación, se basa en la predicción de la velocidad de secado con la ayuda de modelos matemáticos adecuados. Los modelos matemáticos de cinética de secado se pueden clasificar en tres grupos: empíricos exponenciales, empíricos no exponenciales y los modelos de la segunda ley de Fick o difusionales. Con el modelado se intenta establecer un modelo real para simplificar y delimitar el proceso. En la Tabla 1 constan los modelos matemáticos empleados para modelar la cinética de secado de las hojas de muña (Babu et al., 2018).
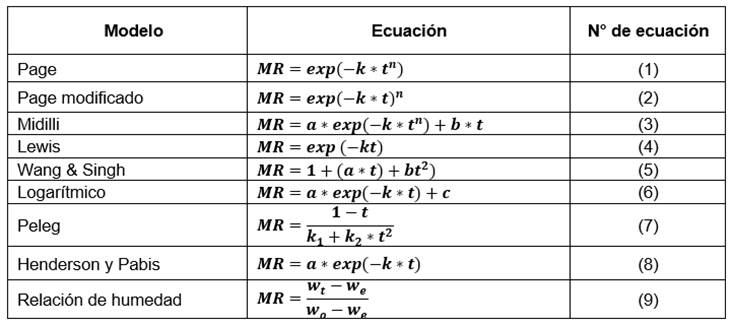
Donde:
a,b,c,k,n son constantes de los modelos cinéticos
MR es relación de humedad
Wt es el contenido de humedad en tiempo real (g agua/ g de muestra)
W0 es el contenido de humedad inicial (g agua/ g de muestra)
We es el contenido de humedad en equilibrio (g agua/ g de muestra)
2.5. Energía de activación y propiedades termodinámicas
Para calcular el coeficiente de difusividad efectiva, se empleó la segunda ley de Fick, en la cual se describe de forma adecuada los fenómenos de difusividad en la transferencia de masa en la muestra durante el secado hasta llegar al equilibrio. Teniendo en cuenta que las hojas de muña son lo más cercano a una lámina infinita, la transferencia de masa es unidimensional con tiempos de secado largos. El modelo matemático se expresa en la ecuación 10:

Donde:
Deff es coeficiente de difusividad efectiva 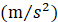
L0 es el semiespesor de la hoja a secar 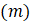
Deff se determinó a través del gráfico In(MR) versus tiempo de los datos experimentales, por medio de la pendiente 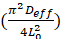 de la ecuación 10.
de la ecuación 10.
Por lo general, el coeficiente de difusividad efectiva del agua en los alimentos depende predominantemente de la temperatura de secado y presenta una tendencia tipo Arrhenius. Para evaluar la dependencia de las constantes empíricas en función a la temperatura, se empleó la ecuación linealizada de Arrhenius (ecuación 11). Los parámetros cinéticos energía de activación (Ea) y constante de difusión inicial (D0) se estimaron a partir de la pendiente y la intersección del gráfico In (Deff) versus (1/T) (Bahammou et al., 2019).

Donde:
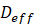 es una constante cinética para evaluar las constantes empíricas
es una constante cinética para evaluar las constantes empíricas
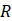 es la constante universal de los gases
es la constante universal de los gases 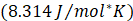
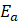 es la energía de activación
es la energía de activación 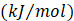
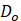 es el factor Arrhenius (m2/s)
es el factor Arrhenius (m2/s)
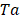 es la temperatura absoluta
es la temperatura absoluta 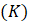 .
.
Conociendo la energía de activación, se determinó la entalpía diferencial (ecuación 12), la entropía diferencial (ecuación 13) y la energía libre de Gibbs (ecuación 14) (Jideani & Mpotokwana 2009) mediante las siguientes ecuaciones:



Donde:
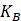 es constante de Boltzmann
es constante de Boltzmann 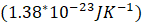
hp constante de Planck (6.62 *10-34J*S)
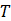 temperatura absoluta
temperatura absoluta 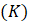 .
.
2.6. Análisis estadístico
La bondad de ajuste de los modelos propuestos para la cinética de secado se evaluó mediante pruebas estadísticas que incluyen el error de suma cuadrada, 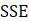 (ecuación 15); raíz cuadrada del error medio al cuadrado, RMSE (ecuación 16); el coeficiente de determinación,
(ecuación 15); raíz cuadrada del error medio al cuadrado, RMSE (ecuación 16); el coeficiente de determinación,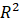 (ecuación 17), y el cuadrado medio del error (
(ecuación 17), y el cuadrado medio del error (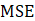 , ecuación 18), empleando el software XLSTAT 2020 versión trial. Los valores más bajos de
, ecuación 18), empleando el software XLSTAT 2020 versión trial. Los valores más bajos de 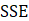 y
y 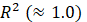 y los valores más altos del coeficiente de determinación se consideraron como criterios para seleccionar el mejor ajuste entre los modelos.
y los valores más altos del coeficiente de determinación se consideraron como criterios para seleccionar el mejor ajuste entre los modelos.




Donde:
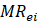 es el contenido de humedad experimental
es el contenido de humedad experimental
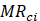 es el contenido de humedad calculado
es el contenido de humedad calculado
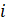 es el número de términos;
es el número de términos; 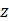 es un número constante
es un número constante
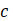 es el valor dado por el modelo y
es el valor dado por el modelo y 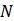 es el número de datos
es el número de datos
3.1. Curvas de cinética de secado
En la Figura 2 están las curvas experimentales del secado de las hojas de muña pretratadas y sometidas a tres temperaturas. Todas las curvas mostraron una clara tendencia decreciente con la relación de humedad  , la cual disminuía rápidamente a medida que se incrementaba la temperatura de secado del aire.
, la cual disminuía rápidamente a medida que se incrementaba la temperatura de secado del aire.
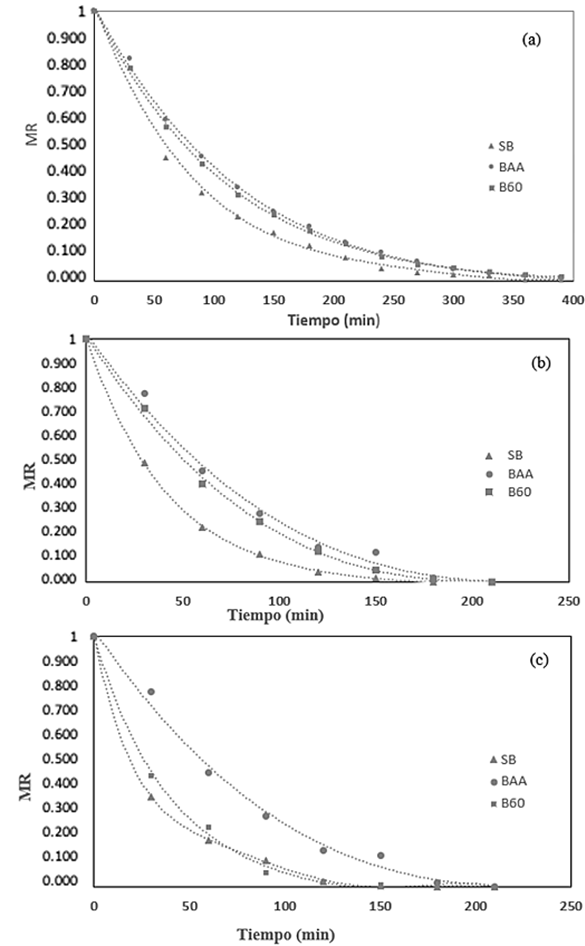
Nota: secado a 40(a), 50(b) y 60(c) °C en las muestras ajustadas al modelo logarítmico.
Se observó que el tiempo de secado fue menor a medida que se elevó la temperatura de secado, es decir, la velocidad de secado incrementó con el aumento de la temperatura del aire de secado. Los tiempos fueron 480, 240 y 210 min a temperaturas de 40, 50 y 60 °C, respectivamente. Por lo tanto, el aumento de la temperatura del aire de secado redujo considerablemente el tiempo necesario para que las hojas de muña tengan un menor contenido de humedad.
Este fenómeno fue constatado por otros investigadores que estudiaron la cinética de secado en otras plantas medicinales, por ejemplo: Martins et al. (2015) los hizo en hojas de timbó; Silva et al. (2015), en jenipapo, y Gasparin et al. (2017), en hojas de Mentha piperita. El efecto de la temperatura del aire de secado sobre la reducción del tiempo de secado de las hojas de muña puede atribuirse al hecho de que la causa principal del proceso de secado es la diferencia de presión de vapor entre el producto y el aire de secado. La diferencia de presión de vapor aumenta con el incremento en la temperatura del aire de secado (Martins et al., 2015).
A temperaturas más bajas, el tiempo necesario para eliminar el agua de la superficie del producto es mayor que a temperaturas más altas, debido a que, a menor temperatura, la contribución a la remoción de agua presente en la superficie es baja. Este comportamiento de menor tiempo de secado a mayores temperaturas puede explicarse por la estructura de las hojas, las condiciones de secado, el aumento de los coeficientes de transferencia de masa y el incremento de la gradiente de presión de vapor entre el aire de secado y el aire dentro de las hojas (Bensebia & Allia, 2015; Da Silva et al., 2019).
3.1. Curvas de cinética de secado
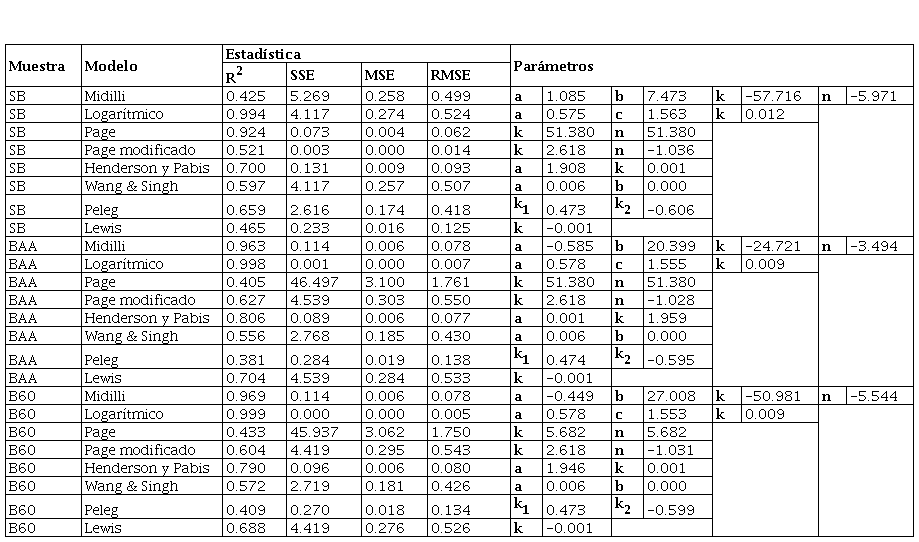
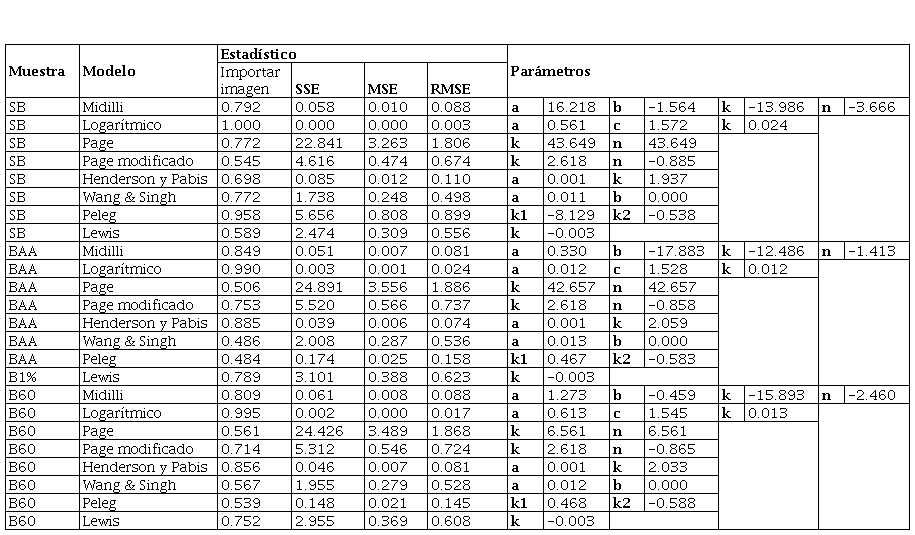
Se utilizaron ocho modelos de secado: Lewis, Page, Page modificado, Henderson y Pabis, logarítmico, Midilli, Peleg y Wang & Singh para describir la cinética de secado de las hojas de muña durante los procesos de secado convectivo, con aire caliente a 40, 50 y 60 °C. Las constantes del modelo y parámetros estadísticos R2, RMSE, SEC y MEC de los ensayos se muestran en las Tablas 2, 3 y 4. Los valores más altos de R2 y los valores más bajos de RMSE fueron seleccionados como criterios para la precisión del ajuste.
El modelo logarítmico proporcionó el mejor ajuste para todos los tratamientos durante el secado experimental en las tres temperaturas, con valores de R2 > 0.990, con excepción de la muestra Sin Tratamiento (SB) secada a 40 °C, donde el mejor ajuste fue el modelo Page. Debido a que los valores de SSE, MSE y RMSE son mucho más cercanos a cero, con respecto al modelo logarítmico, a pesar de que su R2 es 0.924 y el logarítmico es de 0.994, demostrando un buen ajuste de los datos. Quequeto et al. (2019); Martins et al. (2018); Martins et al. (2015) y Gasparin et al. (2017) encontraron valores similares de R2> 0.990 en secado de hojas de Piper aduncuma a 40-60 °C, hojas de mora a 40-70°C, hojas de Serjania marginata a 40-70 °Cy hojas de menta a 30-70 °C, respectivamente. Sin embargo, el modelo de mayor ajuste para describir la cinética de secado en estas investigaciones fue el modelo de Midilli. De igual forma, Silva et al. (2015) y Da Silva et al. (2019) secaron hojas de Genipa americana a 35-65 °C y hojas de boldo a 20-60 °C, respectivamente, y reportaron que el modelo de mayor ajuste fue el de Henderson y Pabis modificado. Del mismo modo, Eneighe et al. (2020) en hojas de Xymalos monospora a 50-70 °C reportaron que sus datos se ajustaron al modelo de Page y Page Modificado. El ajuste al mejor modelo de los datos de secado observados en plantas medicinales está relacionado con la rápida pérdida de agua en las etapas iniciales del proceso en este tipo de hojas, la cual genera una curva de secado más pronunciada y mejor caracterizada por el modelo matemático logarítmico.
3.3. Coeficiente de difusión, propiedades termodinámicas y energía de activación
3.3.1. Coeficiente de difusión de agua
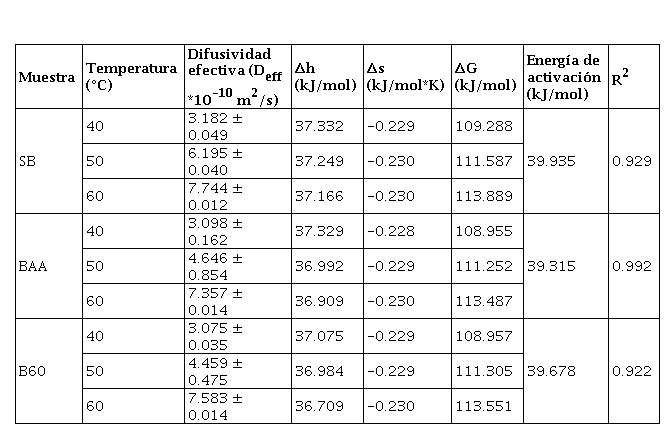
En el método tradicional para estudiar la transferencia de masa en un estado transitorio durante el secado de alimentos se emplea la ecuación de la segunda ley de Fick, pues a partir de ella se puede determinar el coeficiente de difusión del agua (Deff). Los valores de Deff obtenidos para cada muestra a diferentes temperaturas de secado se presentan en la Tabla 5. Los valores de difusividad del agua incrementaron a medida que la temperatura de secado aumentó, por lo que se obtuvo valores entre 3.098 y 7.744 × 10-10 m2/s en el rango de 40-60 °C.
Estos valores fueron similares a los reportados por Doymaz (2006) y Kaya y Aydin (2009) en secado de hojas de menta 0.307-1.941 x 10-8 m2/s entre 35-60 °C y 1.975-6.172 × 10−9 m2/s entre 35-55 °C, respectivamente. Kaya y Aydin (2009) registraron valores en hojas de ortiga entre 1.744-4.992 × 10−9 m2/s entre 35-55 °C, mientras que Doymaz et al., (2006) en hojas de perejil reportó 0.900–2.337 × 10−9 m2/s secado con aire caliente entre 50-70 °C. Por lo tanto, los valores encontrados concuerdan con los datos de difusividad de agua durante el secado de los diferentes tipos de hojas.
3.3.2. Energía de activación
A partir de la pendiente de la línea recta descrita por la ecuación de Arrhenius, se calculó la energía de activación para los diferentes tratamientos (Tabla 5). Estos resultados son similares a los reportados por Lemus-Mondaca et al., (2015), Bensebia y Allia (2015), Doymaz (2006) y Doymaz et al, (2006) 39.91, 66.3, 62.96, 35.05 y 43.92 kJ/mol, en hojas de stevia, menta, laurel, eneldo y perejil, respectivamente. Los datos no presentaron una tendencia definida, pues son similares entre ellos con el incremento de la temperatura.
3.3.3. Propiedades termodinámicas
Tomando en cuenta las propiedades termodinámicas (entalpía específica, entropía específica y energía libre de Gibbs), se observó que los valores de entalpía disminuyeron de 37.3322 a 36.9092 kJ/mol con el incremento de la temperatura (Tabla 5). Por ello, mientras más alta sea la temperatura, se requiere una menor cantidad de energía específica para el secado. La entropía presentó un comportamiento similar, es decir, se redujo de -0.2298 a -0.2361 kJ/mol*K con el aumento de las temperaturas. Los valores negativos de entropía se atribuyeron a la adsorción química y/o modificaciones estructurales del adsorbente (Moreira et al., 2008).
La energía libre de Gibbs aumentó con el incremento de la temperatura de secado, lo que indica que dicho secado no fue espontáneo en las condiciones de este trabajo; esto quiere decir que se produjo una reacción endergónica, por lo tanto, necesitaba de la adición de energía en el medio en el que se encontraba el producto para que ocurriera el secado. Los valores encontrados de energía libre de Gibbs para las hojas pretratadas se encontraron entre 108.955 a 113.889 kJ/mol entre 40 a 60 °C. Los valores encontrados de Δh, Δs y ΔG fueron inferiores a lo reportados por Quequeto et al. (2019) y Da Silva et al. (2019) en hojas de Piper aduncum (15.200 kJ/mol; -0.303 kJ/mol*K y 147.935 kJ/mol) y hojas de laurel (53.038 kJ/mol; -0.451 kJ/mol*K y 156.587 kJ/mol) secadas a 40-60 °C, respectivamente, aunque el valor del Δh fue superior respecto a las hojas de laurel.
El modelo logarítmico presentó el mejor ajuste estadístico a los datos experimentales de cinética de secado de las hojas de muña, con y sin pretratamiento, sometidas a 40, 50 y 60 °C. El aumento en la temperatura del aire de secado promovió la reducción del tiempo para eliminar el agua de las hojas durante el secado; asimismo, el coeficiente de difusión efectivo (Deff) aumentó con el incremento de la temperatura del aire durante el secado.
La relación entre el coeficiente de difusión efectivo y la temperatura del aire de secado permitió describir la energía de activación; además, el incremento en la temperatura del aire de secado ayudó a reducir los valores de entalpía y entropía específica, mientras que los valores de energía libre de Gibbs mostraron un comportamiento inverso.
Nomenclatura
| a, b, c, k y n | Constantes de los modelos cinéticos |
| Kb | Constante de Boltzman, 1.38*10^-23 J/K |
| Deff | Difusividad térmica, m2/s |
| We | Contenido de humedad en equilibrio, g H2O/g m |
| D0 | Factor de Arrhenius, m2/s |
| R | Constante universal de los gases, kJ/mol*K |
| MR | Relación de humedad |
| r2 | Coeficiente de determinación |
| Ea | Energía de activación, kJ/mol |
| T | Temperatura, °C |
| Wt | Contenido de humedad inicial, g H2O/g m |
| Ta | Temperatura absoluta. K |
| Wt | Contenido de humedad en tiempo real, g H2O/g de m |
| t | tiempo, min |
| Δh | Entalpía específica, kJ/mol |
| L0 | Semiespesor de la hoja, m |
| Δs | Entropía diferencial, kJ/mol*K |
| SSE | Error de suma cuadrada |
| ΔG | la energía libre de Gibbs, kJ/mol |
| RMSE | Raíz cuadrada de los errores al cuadrado |
| hp | Constante de Planck (6.626*10^-34 J*s) |
Aguirre Tipismana, L. G. (2017). Consumo de plantas medicinales en usuarios del Centro Integral del Adulto Mayor de La Molina, Lima-Perú 2016. [Tesis de grado, Universidad de San Martín de Porres]. https://hdl.handle.net/20.500.12727/4398.
Babu, A. K., Kumaresan, G., Raj, V. A. A., & Velraj, R. (2018). Review of leaf drying: Mechanism and influencing parameters, drying methods, nutrient preservation, and mathematical models. Renewable and Sustainable Energy Reviews, 90, 536–556.https://doi.org/10.1016/j.rser.2018.04.002.
Bahammou, Y., Tagnamas, Z., Lamharrar, A., & Idlimam, A. (2019). Thin-layer solar drying characteristics of Moroccan horehound leaves (Marrubium vulgare L.) under natural and forced convection solar drying. Solar Energy, 188, 958–969.https://doi.org/10.1016/j.solener.2019.07.003.
Bensebia, O., & Allia, K. (2015). Drying and extraction kinetics of rosemary leaves: Experiments and modeling. Journal of Essential Oil Bearing Plants, 18(1), 99–111.https://doi.org/10.1080/0972060X.2014.901620.
Bosco, D., Roche, L. A., Della Rocca, P. A., & Mascheroni, R. H. (2018). Osmodehidrocongelación de batata fortificada con zinc y calcio. Innotec: Revista del LATU, 15(ene.-jun.), 23–31.https://doi.org/10.26461/15.05.
Cano, C., Bonilla, P., Roque, M., & Ruiz, J. (2008). Actividad antimicótica in vitro y metabolitos del aceite esencial de las hojas de Minthostachys mollis (muña). Revista Peruana de Medicina Experimental y Salud Pública, 25(3), 298–301.https://doi.org/10.17843/rpmesp.2008.253.1281.
Da Rocha, R. P., Melo, E. D. C., Corbín, J. B., Berbert, P. A., Donzeles, S. M., & Tabar, J. A. (2012). Cinética del secado de tomillo. Revista Brasileira de Engenharia Agrícola e Ambiental, 16(6), 675–683.https://doi.org/10.1590/S1415-43662012000600013.
Da Silva, N. C. B., dos Santos, S. G., da Silva, D. P., Silva, I. L., & Rodovalho, R. S. (2019). Drying kinetics and thermodynamic properties of boldo (Plectranthus barbatus Andrews) leaves. Científica, 47(1), 01–07.https://doi.org/10.15361/1984-5529.2019v47n1p01-07.
Dorneles, L. D. N. S., Goneli, A. L. D., Cardoso, C. A. L., Da Silva, C. B., Hauth, M. R., Oba, G. C., & Schoeninger, V. (2019). Effect of air temperature and velocity on drying kinetics and essential oil composition of Piper umbellatum L. leaves. Industrial Crops and Products, 142, 111846. https://doi.org/10.1016/j.indcrop.2019.111846.
Doymaz, I. (2006). Thin-layer drying behaviour of mint leaves. Journal of Food Engineering, 74(3), 370–375.https://doi.org/10.1016/j.jfoodeng.2005.03.009
Doymaz, İ., Tugrul, N., & Pala, M. (2006). Drying characteristics of dill and parsley leaves. Journal of Food Engineering, 77(3), 559–565. https://doi.org/10.1016/j.jfoodeng.2005.06.070.
Eneighe, S. A., Dzelagha, F. B., & Nde, D. B. (2020). Production of an herbal green tea from ambang (Xymalos monospora) leaves: Influence of drying method and temperature on the drying kinetics and tea quality. Journal of Food Science and Technology, 57(9), 3381–3389. https://doi.org/10.1007/s13197-020-04371-z.
Fernando, J. A. K. M., & Amarasinghe, A. D. U. S. (2016). Drying kinetics and mathematical modeling of hot air drying of coconut coir pith. SpringerPlus, 5(1), 1–12. https://doi.org/10.1186/s40064-016-2387-y.
Gasparin, P. P., Christ, D., & Coelho, S. R. M. (2017). Secagem de folhas Mentha piperita em leito fixo utilizando diferentes temperaturas e velocidades de ar. Revista Ciência Agronômica, 48(2), 242–250. https://doi.org/10.5935/1806-6690.20170028.
Instituto Nacional de Estadística e Informática–Perú (2017): Estimaciones y proyecciones de población, 1950-2050. Boletín de Análisis Demográfico, 35. https://www.inei.gob.pe/media/MenuRecursivo/publicaciones_digitales/Est/Lib0466/Libro.pdf.Consultado el 15 de julio 2021.
Jideani, V. A., & Mpotokwana, S. M. (2009). Modeling of water absorption of Botswana bambara varieties using Peleg’s equation. Journal of Food Engineering, 92(2), 182–188. https://doi.org/10.1016/j.jfoodeng.2008.10.040.
Kaya, A., & Aydin, O. (2009). An experimental study on drying kinetics of some herbal leaves. Energy Conversion and Management, 50(1), 118–124. https://doi.org/10.1016/j.enconman.2008.08.024.
Khodja, Y. K., Dahmoune, F., Madani, K., & Khettal, B. (2020). Conventional method and microwave drying kinetics of Laurus nobilis leaves: Effects on phenolic compounds and antioxidant activity. Brazilian Journal of Food Technology, 23, 1–10. https://bit.ly/3uGjZco.
Lemus‐Mondaca, R., Vega‐Gálvez, A., Moraga, N. O., & Astudillo, S. (2015). Dehydration of Stevia rebaudiana bertoni leaves: Kinetics, modeling and energy features. Journal of Food Processing and Preservation, 39(5), 508–520. https://doi.org/10.1111/jfpp.12256.
Martins, E. A., Lage, E. Z., Goneli, A. L., Hartmann Filho, C. P., & Lopes, J. G. (2015). Cinética de secagem de folhas de timbó (Serjania marginata Casar). Revista Brasileira de Engenharia Agrícola e Ambiental, 19(3), 238–244. https://doi.org/10.1590/1807-1929/agriambi.v19n3p238-244.
Martins, E. A., Goneli, A. L., Goncalves, A. A., Hartmann Filho, C. P., Siqueira, V. C., & Oba, G. C. (2018). Drying kinetics of blackberry leaves. Revista Brasileira de Engenharia Agrícola e Ambiental, 22(8), 570–576. https://doi.org/10.1590/1807-1929/agriambi.v22n8p570-576.
Moreira, R., Chenlo, F., Torres, M. D., & Vallejo, N. (2008). Thermodynamic analysis of experimental sorption isotherms of loquat and quince fruits. Journal of Food Engineering, 88(4), 514–521.https://doi.org/10.1016/j.jfoodeng.2008.03.011.
PromPerú - Comisión de Promoción del Perú para la Exportación y el Turismo. (2021). Súper Muña. https://peru.info/es-pe/superfoods/detalle/super-muna. Consultado el 15 de julio 2021..
Przeor, M., Flaczyk, E., Beszterda, M., Szymandera-Buszka, K. E., Piechocka, J., Kmiecik, D., & Tylewicz, U. (2019). Air-drying temperature changes the content of the phenolic acids and flavonols in white mulberry (Morus alba L.) leaves. Ciência Rural, 49(11)https://doi.org/10.1590/0103-8478cr2019048.
Pucurimay, D. P., Park, J. S., Moscoso M. R., & Granara Salazar, A. (2018). Diferencias en la presencia de alcaloides y fenoles de cinco muestras de muña de expendio informal procedentes de mercados populares en Lima-Perú. Horizonte Médico (Lima), 18(3), 25–29. http://dx.doi.org/10.24265/horizmed.2018.v18n3.05.
Quequeto, W. D., Siqueira, V. C., Mabasso, G. A., Pedroza Isquierdo, E.., Araujo Leite, R., Ferraz Rodrigues, L., Hoscher, R. H., Schoeninger,V., Jordan, R. A, Duarte Goneli, A. L.,& Martins Siqueira, E. A. S. (2019). Mathematical modeling of thin-layer drying kinetics of Piper aduncum L. leaves. Journal of Agricultural Science, 11(8), 225–235. https://doi.org/10.5539/jas.v11n8p225.
Roersch, C. (2016). Medicinal plants in the Dominican Republic and their possible role in public health care. Acta Horticulturae, 1125, 249–254. https://doi.org/10.17660/ActaHortic.2016.1125.31.